
 |
|
中国科学院昆明动物研究所郑永唐研究员学科组首次建立SIVmac239感染北平顶猴(Macaca leonina)艾滋病动物模型并研究了其免疫发病机制,同时根据其艾滋病进展速度将其分为快速进展组(RP)和缓慢进展组(SP)(Zhang MX et al, Immunology, 2017; Zhang MX et al, Eur J Immunol, 2018; Zhang MX et al, Zool Res, 2019)。为了研究疾病进展速度与肺部免疫微环境之间的关系,该团队对两组实验动物进行了肺部16SrDNA和转录组测序,以揭示RP和SP之间疾病进展差异的分子机制。研究发现,RP组的微生物组成与SP组不同,RP组存在Family XI、Enterococcus及Ezakiella等标志性菌群以及丰度更多的乳酸杆菌,提示RP组可能出现肺部微生物感染。通过肺组织转录组分析,明确了RP组炎症反应相关的分子明显上调,这是微生物侵袭导致的结果。同时还发现转录因子ZNF683在SP组的表达显著高于RP组。在随后功能验证实验中,发现ZNF683增加了CD8+ T细胞的增殖和IFN-γ的分泌能力,从而减少了SIV或HIV的复制,进一步抑制了微生物侵袭。这些结果表明,ZNF683可能是CD8+ T细胞功能的标志物并与SIVmac239感染北平顶猴的艾滋病发病进展有关(图1)。该研究有助于阐明HIV-1感染者疾病进展机制,相关研究结果以“Transcription factor ZNF683 inhibits SIV/HIV replication through regulating IFNγ secretion of CD8+ T cells”为题发表于国际学术期刊《Viruses》(2022, 14:719)上,中国科学院昆明动物研究所博士研究生路莹、张明旭为该论文的共同第一作者,郑永唐研究员通讯作者。
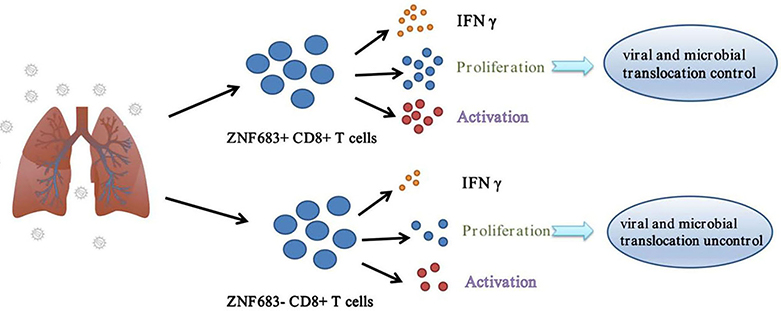
图1. 转录因子ZNF683在HIV-1感染中的抑制作用
IFN-α在HIV-1急性感染阶段具有抑制病毒复制的作用,但其在慢性感染中的作用尚不明确。郑永唐研究员学科组在前期研究中还首次阐明了平顶猴HIV易感分子机制(Liao CH et al, AIDS. 2007; Kuang YQ et al, Retrovirology, 2009)并创建了HIV-1慢性感染北平顶猴模型,发现HIV-1在北平顶猴体内呈现持续性低水平复制及宿主限制因子APOBEC3的可能作用机制(Pang W et al, Sci Bull, 2017; Pang W et al, Front Immunol, 2018; Zhang XL et al, J Virol, 2020)。为了研究IFN-α在HIV-1慢性感染阶段的作用,该学科团队比较研究了HIV-1和SIVmac239感染北平顶猴艾滋病动物模型的IFN产生与病毒复制及发病进展的相关性,发现SIVmac239感染北平顶猴慢性期淋巴组织中病毒DNA和RNA水平显著高于HIV-1感染的北平顶猴。此外,HIV-1感染北平顶猴的组织中IFN-α表达也高于SIVmac239感染北平顶猴。通过RT-qPCR和IF检测了由IFN-α诱导的宿主病毒限制因子Tetherin和MX2以及炎性因子IFN-γ、TNF-α和IL-6,发现它们在HIV-1感染北平顶猴的组织中表达水平也高于SIVmac239感染北平顶猴。体外实验也证明了HIV-1病毒在北平顶猴PBMC中复制较低,IFN-α表达较高,且处于更高的抗病毒状态。该研究表明,HIV-1能够比SIVmac239在北平顶猴中诱导更高的IFN-α表达,并导致更高的抗病毒状态(图2),这可能是HIV-1在北平顶猴体内持续性低水平复制或缓慢发病的原因之一。相关研究结果以“HIV-1 but not SIVmac239 induces higher interferon-α antiviral state in chronic infected northern pig-tailed macaques (Macaca leonina)”为题发表在国际学术期刊《Microbes and infection》(2022, 24:104970)上,何文强博士研究生为该论文第一作者,庞伟副研究员和郑永唐研究员为通讯作者。
以上研究均得到了国家重点研发计划、国家自然科学基金等项目的资助。
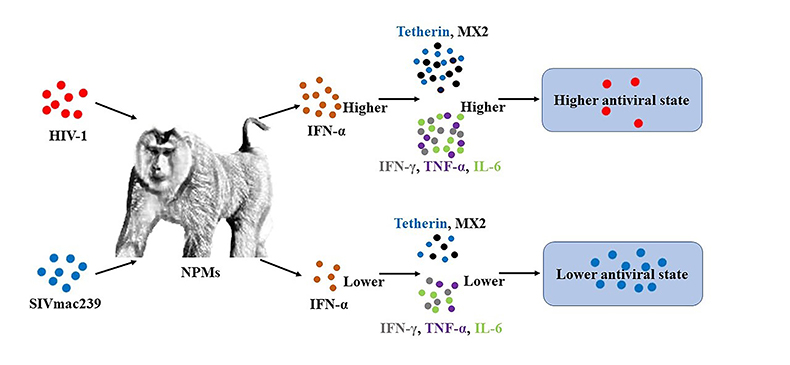
图2. HIV-1比SIVmac239在北平顶猴体内能够诱导更高的抗病毒状态
|
|