
 |
|
不饱和脂肪酸,如油酸(OA)、花生四烯酸(AA)、DHA和EPA等是重要的脂类分子,参与生物膜构成、信号传递、能量储存等。不饱和脂肪酸的合成由多个代谢酶,如去饱和酶(desaturases)、延长酶(elongase)等参与。脂肪酸去饱和化反应中,电子经细胞色素b5还原酶(cytocytochrome b5 reductase)传递给细胞色素b5(cytochrome b5),后者把电子传递给去饱和酶,激活的去饱和酶在脂肪酸碳链特定位置引入不饱和键,合成不饱和脂肪酸。因此,识别不同脂肪酸碳链特定位置的不同去饱和酶是如何与相同或者完全不同的细胞色素b5还原酶和细胞色素b5组成电子传递复合物参与不饱和脂肪酸合成,知之甚少。
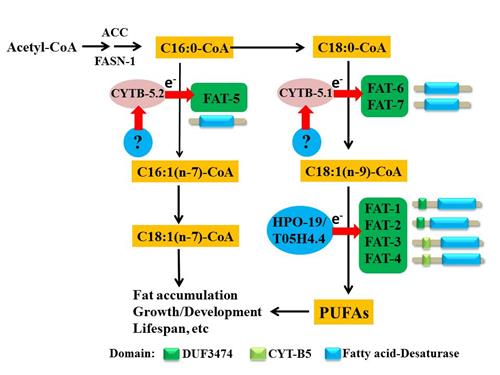
模式生物秀丽线虫有7个去饱和酶,分别是FAT-1 至FAT-7,参与合成如油酸(OA)、花生四烯酸(AA)、DHA和EPA等所有不饱和脂肪酸。因此,秀丽线虫是研究不饱和脂肪酸合成和调控的极佳动物模型。前期,梁斌实验室(张玉茹博士和张静静博士等)揭示,FAT-1,2,3和4蛋白都具有一个细胞色素b5的结构域和一个去饱和酶结构域,电子经过细胞色素b5还原酶HPO-19/T05H4.4交给这些去饱和酶,合成多聚不饱和脂肪酸(BBA-Molecular and Cell Biology of Lipids, 2016)。
FAT-5, 6和7是硬脂酰辅酶A去饱和酶(stearoyl-CoA desaturase, SCD),也称之为Δ9去饱和酶。它们参与不饱和脂肪酸合成的第一步,即在饱和脂肪酸棕榈酸C16:0和硬脂酸C18:0的第9位和10位碳原子间引入双键,分别将其转变为单不饱和脂肪酸棕榈油酸C16:1(n-7)和油酸C18:1(n-9)。前期,梁斌实验室揭示SCD调控脂滴大小(Journal of Lipid Research,2013),发现金属离子锌和铁互相拮抗调控SCD活性和脂肪合成(Journal of Lipid Research,2017,被选为9月刊的封面故事)。然而,FAT-5, 6和7蛋白缺乏细胞色素b5结构域,提示可能存在独立的细胞色素b5蛋白。
梁斌课题组的何宝申研究生和张静静博后通过蛋白同源性分析,在秀丽线虫基因组中找到了2个可能编码细胞色素b5的基因cytb-5.1和cytb-5.2。进一步的功能研究发现,CYTB-5.1特异影响FAT-6/7的功能,参与C18:0转化为C18:1(n-9);而CYTB-5.2特异影响FAT-5的功能,参与C16:0转化为C16:1(n-7)。蛋白共定位和免疫共沉淀实验也证实,CYTB-5.1和CYTB-5.2能够分别和FAT-6/7和FAT-5相互作用。此外,CYTB-5.1和CYTB-5.2的功能受阻,影响秀丽线虫的脂肪累积、后代数目和寿命。
该研究工作已接收并在线发表在国际脂代谢领域知名期刊BBA-Molecular and Cell Biology of Lipids(https://www.sciencedirect.com/science/article/pii/S1388198117302445)。该项研究工作得到了中国科学院先导B类、国家自然科学基金、中国博士后基金等项目资助。
|
|