面对凶狠又狡诈的癌症,人体内的硬骨头不多,顺风倒的软骨头反倒是一抓一大把:正常组织细胞被拉拢,肠道微生物主动投敌,免疫细胞也会敌我不分,比如肿瘤相关性巨噬细胞和中性粒细胞,它们本应该是从骨髓老家出来抗癌的,但一到前线立马就投敌叛逃,反倒开始促进癌细胞的生长[1],真是让奇点糕颇有唏嘘之感……
 一旦套上了肿瘤相关性的帽子,巨噬细胞和中性粒细胞就不是什么好东西了
一旦套上了肿瘤相关性的帽子,巨噬细胞和中性粒细胞就不是什么好东西了
这些免疫细胞为什么去帮助癌症呢?也许在骨骼里“内奸”的有意策划下,它们一出生就是叛徒!在今天的《科学》上,哈佛大学的研究团队就发现,骨组织里的成骨细胞(osteoblast)在肺癌早期就会接受癌细胞的远程指示,生成对癌症增殖至关重要的中性粒细胞,帮助肺癌进展[2]!还没等癌细胞转移过来,成骨细胞就已经当上了带路党,简直是软骨头到家了!
骨骼并不是人体内沉默的旁观者,今年年初,《自然》上的文章就首次证实了骨骼与大脑的交流能力: 《Nature》:再次改写教科书!科学家发现骨骼能够分泌与大脑交流的激素,骨骼作为沉默旁观者的时代结束了!| 科学大发现,但对骨骼在癌症中的作用,科研界此前主要是从骨髓角度进行探索。骨髓是人体主要的造血场所,中性粒细胞、巨噬细胞等多种免疫细胞都是来自骨髓[3]。
老话说“敲骨吸髓”,不过此前总认为骨骼沉默,负责造血的骨髓则很活跃
但对于一部分免疫细胞如何从骨髓生成时的“乖宝宝”化身肿瘤帮凶,科学家们一直没搞懂具体的机制。骨骼本身的组织细胞会不会也参与其中呢?以Mikael Pittet教授为首的哈佛大学研究团队决定一探究竟。
利用荧光染色技术,研究人员分析了肺癌模型小鼠的骨骼状况,发现即使在未出现骨转移灶的癌症早期,小鼠胸骨、肋骨、脊椎骨和盆骨等全身多处骨骼就已经受到了影响,骨密度普遍升高,提示新骨生成,这一发现也在经确诊且未见转移的70名非小细胞肺癌患者体内得到了证实。
在小鼠新生的骨组织内,成骨细胞的数目增多,活跃度上升,基因表达水平也有明显改变,而破骨细胞(osteoclast)并无这样的变化。成骨细胞在骨骼当中负责形成新的骨组织,破骨细胞与其作用相反,看来肺癌对骨骼的影响肯定和成骨细胞脱不了干系。
成骨细胞中发生变化的主要的是骨钙素(osteocalcin)表达阳性(OCN+)的细胞(后文统一简称骨钙素成骨细胞)。为了进一步验证这些细胞的作用,研究人员使用白喉霉素对小鼠进行处理,清除掉了骨钙素成骨细胞,这些小鼠的肺癌进展就受到明显抑制,肿瘤较对照组缩小了近40%!而白喉霉素用于已清除骨钙素成骨细胞的小鼠时,并不会单独体现抑癌效果,因此肿瘤的缩小就是由缺少骨钙素成骨细胞所致。
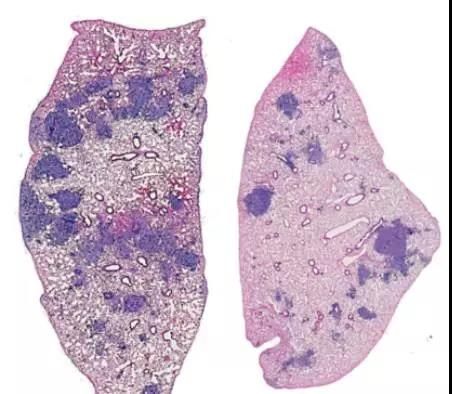
免疫染色清晰体现了对照组(左)和清除OCN+成骨细胞组(右)肺癌进展的差异,深色的癌灶区在清除OCN+组中明显减少
新的疑问又来了,成骨细胞和肺癌细胞在体内可以说是远隔千里,怎么有着如此明显的关联?研究人员想到了肿瘤相关性巨噬细胞和中性粒细胞,如果成骨细胞通过干预这两类来自骨髓的癌症“帮凶”的产生影响癌症进展,那一切就都说得通了。
为了验证这种猜想,研究人员比较了骨钙素成骨细胞水平不同的肺癌小鼠肿瘤微环境内的免疫细胞,发现骨钙素成骨细胞较多的小鼠体内,一种中性粒细胞(CD11b+ Ly-6G+)的数量是正常小鼠的两倍,处理掉骨钙素成骨细胞后,这种中性粒细胞就不会继续增加,而定向清除这种中性粒细胞也可以使小鼠的肺癌明显缩小。
借助免疫荧光技术,研究人员对这些中性粒细胞进行了进一步细分,发现只有高表达凝集素SiglecF的中性粒细胞才会在肺癌小鼠中暴增,如果处理掉骨钙素成骨细胞,就观察不到这种超过70倍的疯狂增长。
基因测序的结果显示,SiglecF高表达的中性粒细胞基因表达与正常细胞显著不同,与肿瘤新生血管形成、抑制免疫应答、促进癌细胞增殖等多种机制有关的基因表达水平显著上调,将它们从体内提取出,再与癌细胞混合在一起进行的验证性实验也显示,这些中性粒细胞的确可以“助纣为虐”,促进癌细胞数目迅速增加。
那么SiglecF高表达的中性粒细胞对肺癌患者影响有多大呢?研究人员进行的分析显示,当这些中性粒细胞数目较多时,患者的50个月生存率只有约50%,而数目较少时会升高到近75%,差异达到了惊人的25%!因此对肺癌患者的中性粒细胞进行相关检测,可能有着重要的临床价值。

高表达SiglecF的中性粒细胞对患者生存率和生存时间有明显影响
可肺癌细胞又是怎么远程遥控骨骼,增强了自身的实力呢?本次研究没有给出完整的答案,但初步分析显示,可溶性糖基化终末产物(sRAGE)在内的多种免疫相关分子可能成为了癌细胞的信使,向成骨细胞传递了激活信号。
“癌症是一种全身性疾病”的观点多年来一直存在争议,就算是常见肺外症状的肺癌也不例外。但本次研究充分证明,骨骼与癌细胞之间存在关键的远程交流,甚至足以影响癌症的进一步发展,因此通讯作者Pittet教授也表示,希望对相关通路进行治疗探索,能突破当前肺癌治疗的某些瓶颈[4]。
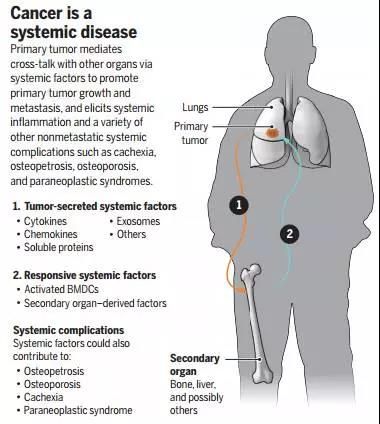
想要彻底弄清癌症作为“全身性疾病”的机制,还是前路漫漫
《科学》同期配发的评论文章则基于本次发现提出了一连串新的问题:其他的器官会不会也有与癌症之间的交流机制?这种机制有没有参与癌症的远处转移?癌症在原发器官之外的症状是否也是由中性粒细胞引起的[5]?
“不知道的奥秘万万千千,智慧简单却不简单。”连骨骼都能被远程控制,也无怪于有人认为,癌细胞在进化水平上可能远超正常细胞。既能战胜人体复杂的免疫系统,还不断拉拢各种帮手,怎么可能是善类?所以奇点糕觉得,为了战胜这些强悍的对手,可能真要拿出“就是崩了门牙,也要咬开它”的气势……
参考资料:
1.Engblom C, Pfirschke C, Pittet M J. The role of myeloid cells in cancer therapies[J]. Nature Reviews Cancer, 2016, 16(7): 447-462.
2.http://science.sciencemag.org/content/358/6367/eaal5081
3.Morrison S J, Scadden D T. The bone marrow niche for haematopoietic stem cells[J]. Nature, 2014, 505(7483): 327-334.
4.http://www.massgeneral.org/about/pressrelease.aspx?id=2177
5.http://science.sciencemag.org/content/358/6367/1127