
 |
|
卵巢癌是造成女性死亡的第五大肿瘤。由于其发病位置的隐蔽性,以及缺乏有效的早期检测指标,导致卵巢癌致死率居于所有妇科肿瘤之首,对女性生命造成严重威胁。最新研究数据表明恶性程度高的卵巢癌病人五年生存率甚至低于30%。然而到目前为止,卵巢癌的发病机理尚未完全清楚,因此对卵巢癌发生和发展的分子机制进行更深入的研究显得非常有必要。
泛素介导的蛋白质降解对于肿瘤的发生发展至关重要,且HECT E3泛素连接酶越来越成为肿瘤治疗的靶点。HUWE1(HECT,UBA and WWE domain containing 1,E3 ubiquitin protein ligase,又名MULE,Ib772,LASU1,UREB1,ARF-BP1等)是一种3’末端含HECT结构域的E3泛素化连接酶,分子量为482kDa。HUWE1通过调节其底物的稳定性,控制着细胞内大量与肿瘤发生密切相关的生物学过程,例如DNA损伤修复、细胞增殖、凋亡、分化以及细胞内稳态等。目前关于HUWE1是抑癌基因还是原癌基因仍存在很大争议,这可能取决于肿瘤类型。据报道在大约70%的卵巢癌中HUWE1表达上调,但具体作用不明。
在本研究中我们发现Huwe1敲除抑制正常卵巢上皮细胞的恶性转化,但并不影响细胞存活和凋亡;此外在肿瘤形成后敲除Huwe1,肿瘤生长受到明显抑制。在Huwe1功能缺失的细胞中,组蛋白H1.3表达升高,同时H19表达受到抑制。在细胞中沉默H19可模拟Huwe1敲除出现的表型,若同时敲降组蛋白H1.3能够在一定程度上援救H19的表达以及Huwe1敲除出现的表型。在人卵巢癌细胞中诱导敲降HUWE1,能够重复在小鼠实验中得到的结论。在机制上,我们发现HUWE1可结合并且泛素化组蛋白H1.3,并导致H1.3被蛋白酶体降解。这些结果证明了HUWE1是维持卵巢癌发生和发展必需的。因此HUWE1功能调节极有可能是药物治疗的潜在靶标,这为卵巢癌的发病机制和临床治疗提供了新的研究方向。
昆明动物所赵旭东研究员和四川大学邹方东教授为本文通讯作者,四川大学大学生命科学学院博士研究生杨东、昆明动物研究所博士研究生孙彬及广州市妇女儿童医疗中心张晓红为本文共同第一作者。这一研究得到了中科院战略先导项目(XDA 01040403)、国家自然科学基金(NSFC,81171960)及云南省高层次人才项目(2012HA014;to X. Zhao)的支持。
论文链接:http://cancerres.aacrjournals.org/content/early/2017/07/07/0008-5472.CAN-16-2597.long
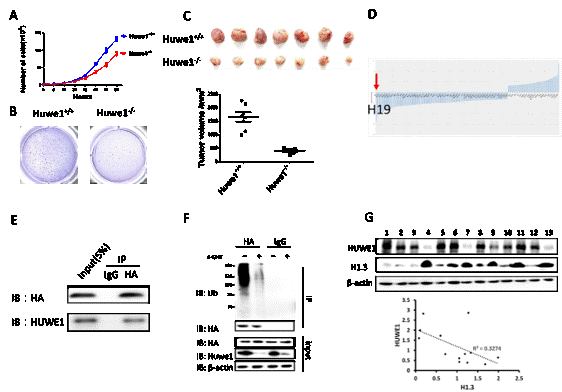
附图:HUWE1通过泛素化降解H1.3维持卵巢癌的发生发展
|
|